Cairan mempunyai beberapa sifat kusus,seperti:
1.MEMPUNYAI TEKANAN
tekanan dapat digolongkan menjadi 2 jenis tekanan,,,
>Tekanan hydrostatik
Bila cairan itu diam dalam medan gravitasi yang sama, tekanan  dalam titik tertentu adalah
dalam titik tertentu adalah
 dalam titik tertentu adalah
dalam titik tertentu adalah , satuan SI : Pascal: N/m²=kg/ms²
, satuan SI : Pascal: N/m²=kg/ms²
dimana  adalah "densitas" dari cairan (dianggap tetap) dan
adalah "densitas" dari cairan (dianggap tetap) dan  adalah kedalaman titik tersebut di bawah permukaan. Catatan, formula ini menganggap tekanan pada permukaan adalah nol, relatif terhadap ketinggian permukaan.
adalah kedalaman titik tersebut di bawah permukaan. Catatan, formula ini menganggap tekanan pada permukaan adalah nol, relatif terhadap ketinggian permukaan.
 adalah "densitas" dari cairan (dianggap tetap) dan
adalah "densitas" dari cairan (dianggap tetap) dan  adalah kedalaman titik tersebut di bawah permukaan. Catatan, formula ini menganggap tekanan pada permukaan adalah nol, relatif terhadap ketinggian permukaan.
adalah kedalaman titik tersebut di bawah permukaan. Catatan, formula ini menganggap tekanan pada permukaan adalah nol, relatif terhadap ketinggian permukaan.
>Tekanan piston atau tekanan hydrolik
Jika permukaan suatu zat cair ditekan dari luar, maka tekanan ini akan bergerak dikarenakan sifat cairan yang flexibel ke segala arah dengan kekuatan yang sama. Rumus:  . oder
. oder 
 . oder
. oder 
2.Gaya Dorong atau Prinsip Archimedes
Sebagai gaya dorong (Fd) dimaksudkan berat yang "hilang", yang dialami sebuah benda bila benda tersebut diletakkan di atas air. Besar suatu gaya dorong adalah sama besarnya dengan jumlah suatu cairan yang ditekan oleh benda tersebut. Atau dengan kata lain, gaya dorong tergantung dari massa jenis cairan tersebut dan volumenya, sedangkan gaya tekan ke bawah oleh benda di air juga tergantung massa jenis benda tersebut serta volumenya. Dimana arah gaya dorong ke atas sedangkan berat benda(G) yang menekan cairan ke bawah sesuai arah gravitasi. Percepatan (a) yang dilakukan cairan yang ditekan sama besarnya dengan percepatan gravitasi (g], sehingga yang memainkan peranan apakah suatu benda mengapung, melayang, atau tenggelam adalah massa jenis benda dan zat cair serta volume benda dan zat cair. Sesuai hukum Archimedes maka dapat kita katakan ada 3 hal yang dapat terjadi: a. Mengapung bila G< Fd, massa jenis benda tersebut < massa jenis cairan
b. Melayang bila G=Fd, massa jenis benda tersebut = massa jenis cairan
c. Tenggelam bila G>Fd, massa jenis benda tersebut > massa jenis cairan
Contoh 1: Sebuah benda mempunyai massa m= 2 kg dan volume v=800cm³. Benda ini melayang di arir dan tergantung di sebuah pegas (g=10cm/s²). Kemudian tampak pada pegas digital tersebut gaya sebesar 12 N. Buktikan
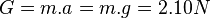

Berat tersisa yang ditahan oleh pegas Contoh 2: Sebuah Balok dengan sisi a= 10cm , b = 15 cm , c = 20cm dengan massa 1 kg, berada di dalam air yang bersuhu T=4 °C. Dalam keseimbangan benda tersebut tampak sepertiga dari volume benda tersebut diam di dalam air. Maka,
Contoh 2: Sebuah Balok dengan sisi a= 10cm , b = 15 cm , c = 20cm dengan massa 1 kg, berada di dalam air yang bersuhu T=4 °C. Dalam keseimbangan benda tersebut tampak sepertiga dari volume benda tersebut diam di dalam air. Maka, 

 Contoh 2: Sebuah Balok dengan sisi a= 10cm , b = 15 cm , c = 20cm dengan massa 1 kg, berada di dalam air yang bersuhu T=4 °C. Dalam keseimbangan benda tersebut tampak sepertiga dari volume benda tersebut diam di dalam air. Maka,
Contoh 2: Sebuah Balok dengan sisi a= 10cm , b = 15 cm , c = 20cm dengan massa 1 kg, berada di dalam air yang bersuhu T=4 °C. Dalam keseimbangan benda tersebut tampak sepertiga dari volume benda tersebut diam di dalam air. Maka, 

[sunting]
3.Viskositas, laminar dan turbulent flow
Viskositas adalah suatu besaran yang menggambarkan sifat kelekatan dari zat cair atau pun gas. Contohnya minyak mempunyai viskositas yang besar. Sebagai standard air diberikan viskositas 1. Darah mempunyai nilai viskositas tertentu;bilamana nilai viskositasnya sangat tinggi dapat menimbulkan bahaya trombose
4.Gaya antarmolekul, tegangan permukaan dan Kapillaritas
Gaya antarmolekul atau Ikatan Van der Waals
Ikatan Van der Waals adalah istilah umum untuk gaya yang terjadi di antara molekul baik pada zat padat, zat cair, ataupun gas. Pada zat padat dan zat cair gaya ini menentukan besarnya volume Dari tipe efeknya dapat dibedakan menjadi= Kohesi, jika gaya tarik terjadi di antara molekul suatu benda yang sejenis. Akibat dari Kohesi adalah yang dinamakan tegangan permukaaan.Adhesi adalah gaya tarik menarik yang timbul di antara molekul2 yang berbeda. Daya serap adalah gaya adhesi yang timbul antara molekul zat padat dengan zat cair atau zat padat dan gas.
[sunting]Tegangan permukaan dan Kapilaritas
Bentuk suatu materi dipisahkan satu sama lain oleh lapisan pembatasnya.Lapisan pembatas menunjukkan sifat yang spesial. Cairan memiliki tegangan permukaan dan kapilaritasDalam suatu zat cair adalah gaya antar molekul sama besar ke segala arah , sehingga mereka saling menetralkan. Pada suatu permukaan molekul zat padat ada tegangan pada yang menguasai permukaannnya dengan arah gaya ke dalam molekul tersebut. Sebagai contoh alveolus. Tegangan permukaan mengakibatkan pengurangan atau reduksi dari permukaan suatu molekul atau dengan kata lain molekul mempunyai kecenderungan untuk mengecil. Pada molekul air tegangan ini dikarenakan ikatan hydrogen maka molekul air mempunyai bentuk seperti bola. Baik Deterjenataupun zat kotor dapat menurunkan tegangan permukaan air. Prinsip dari zat pembersih deterjen. Kapillaritas adalah suatu daya tarik ke atas atau ke bawah yang dialami zat cair bila zat cair tersebut berada dalam suatu pipa kapillar.
Contoh yang paling umum adalah air (kiri) di dalam gelas yang tertarik ke atas oleh sebuah pipa kapillar. Ini dapat dijelaskan karena gaya adhesi (gaya tarik antara molekul air dan pipa kapillar) lebih besar dari gaya kohesi(antar molekul air saja). Pada air raksa (kanan) gaya kohesi (tarik menarik anatar molekul air raksa lebih besar) dari gaya adhesi(tarik menarik antar molekul air raksa dan molekul pipa kapillar)
5.Titik didih, titik beku
Cairan biasanya mengembang bila dipanasi dan menyusut bila didinginkan.
Cairan pada titik didih tertentu berubah menjadi gas, dan pada titik bekunya, berubah menjadi padat. Melalui distilasi bertingkat, cairan dapat dipisahkan satu dengan lainnya karena masing-masing menguap pada titik didih tersendiri.
Ardi Wijanarko
Ardi Wijanarko









